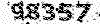پاسخ تشریحی تست ۲۱۳ کنکور ریاضی سال ۹۱
ابتدا واکنش شیمیایی را نوشته موازنه می کنیم :
(۲HCl + CaCo3 → CaCl2 + H2Co3(Co2 + H2O
سپس تعداد مول مواد واکنش دهنده را محاسبه می نمایم :
HCl :
با داشتن حجم و غلظت مولی به راحتی از فرمول زیر تعداد مول آنرا بدست می آوریم . CM=n / V که در آن CM غلظت مولی یا مولاریته, n تعداد مول و V حجم محلول بر حسب لیتر است. پس تعد اد مول HCl از رابطه زیر بدست می آید :
تعداد مول = مولاریته * حجم محلول بر حسب لیتر
n= 4 * 0.025 = 0.1
CaCo3 :
از فرمول n = m / M که در آن m جرم ماده بر حسب گرم و M جرم مولی ماده است, تعداد مولش بدست می آید :
n = 4 / 100 = 0.04
روش تعیین واکنشگر محدود کننده و اضافی :
کافی است تعداد مول هر واکنش دهنده را بر ضریبش در معادله موازنه شده واکنش تقسیم کنیم , عدد حاصل کمتر, محدود کننده و عدد بزرگتر, واکنش دهنده اضافی خواهد بود.
بنابر این در این تست, CaCo3 محدود کننده خواهد بود.
محاسبه حجم گاز تولیدی در واکنش :
از آنجاییکه H2Co3 ناپایدار است, آنرا در واکنش های شیمیای به صورت Co2 + H2O می نویسیم. پس گاز آزاد شده Co2 است.
برای محاسبه حجم این گاز بایستی واکنش دهنده محدود کننده را با این گاز در قالب یک تناسب و با ذکر ضریبشان و واحد هر کدام به یکدیگر مربوط کنیم :
بهتر است خط اول تناسب را با اطلاعات مسئله کامل کنیم و بجای مجهول X قرار دهیم.
|
Co2 |
CaCo3 |
|
X لیتر |
۰٫۰۴ مول |
|
۲۲٫۴×۱ |
۱ |
در حل مسائل به روش تناسب, هر گاه واحد خط اول مول بود در خط دوم کافی است فقط ضریب ماده در معادله شیمیایی موازنه شده را قرار دهیم و هر گاه خط اول در شرایط استاندارد,متعارفی و یا STP ,لیتر بود در خط دوم ضریب ضربدر ۲۲٫۴ قرار دهیم.
پس از حل این تناسب ۰٫۸۹۶ بدست می آید.
بنابر این گزینه صحیح, ۴ می باشد.
پر واضح است که با دانستن اینکه CaCo3 واکنش دهنده محدود کننده و HCl اضافی است و اینکه Co2 گاز حاصل است, گزینه صحیح یافته شده و نیاز به ادامه حل نداریم.